Wer an Krebs erkrankt, hatte lange Zeit nur drei Möglichkeiten: Operation, Chemotherapie und Bestrahlung. Seit einigen Jahren gibt es zielgerichtete Therapien wie Gleevec® oder Herceptin®, die dann zum Einsatz kommen, wenn Krebszellen spezifische Mutationen tragen. Nun lässt ein neuer Ansatz aufhorchen: CAR T, eine Kombination aus Zelltherapie, Gentherapie und Immuntherapie feiert erste Erfolge in der Klinik und zieht Pharmakonzerne und Investoren magisch an.
Was lange währt…
Der Ansatz ist nicht neu, schon in den späten 80er Jahren forschte Zelig Eshhar am Weizmann Institute of Science an den ersten CAR T-Zellen. Doch erst die Fortschritte in Genomik, Proteomik und Molekularbiologie haben die CAR T-Zelltherapie in eine ernstzunehmende Therapieform transformiert. Seit immer mehr Studien ihr Potenzial bestätigen, fließen Millionenbeträge in die Grundlagenforschung und in Biotechnologie-Unternehmen. So investierte Novartis 20 Millionen US-Dollar in den Aufbau eines Zentrums für „Advanced Cellular Therapeutics“, um gemeinsam mit der Penn State University CAR T-Zelltherapeutika zu produzieren. Das erste Produkt zur Behandlung der akuten lymphoblastischen Leukämie (ALL) besitzt den „Breakthrough Status“, ein Zulassungsantrag ist für 2016 geplant.
T-Zellen im Trainingscamp
Man nehme ein Eiweiß, das Krebszellen erkennt, packe dessen Gen in ein nicht-infektiöses Virus und schleuse dieses Konstrukt in menschliche T-Zellen ein: Fertig ist die Immuntherapie gegen Krebs! Was trivial klingt, war ein langwieriger Prozess, hat Millionen an Forschungsgeldern verschlungen und wohl zahlreiche Doktoranden verschlissen. Was steckt hinter CAR T und kann diese neue Therapieform den hohen Erwartungen gerecht werden?
CAR ist ein Akronym und steht für „Chimeric Antigen Receptor“, das „T“ steht für T-Zelle, eine von vielen spezialisierten Zellen des menschlichen Immunsystems. Da entartete Zellen verschiedene Schutzmechanismen entwickeln, bleiben die Waffen des Immunsystems bei Krebs häufig stumpf. Genau hier setzt CAR T an: Gentechnisch-modifizierte T-Zellen sollen Krebszellen wieder erkennen, sie ihrer immundämpfenden Wirkung berauben und so ihre Zerstörung einleiten. Das Funktionsprinzip gleicht einem Training, bei dem patienteneigene T-Zellen wieder lernen sollen, zwischen gesunden und kranken Zellen zu differenzieren und letztere zu attackieren.
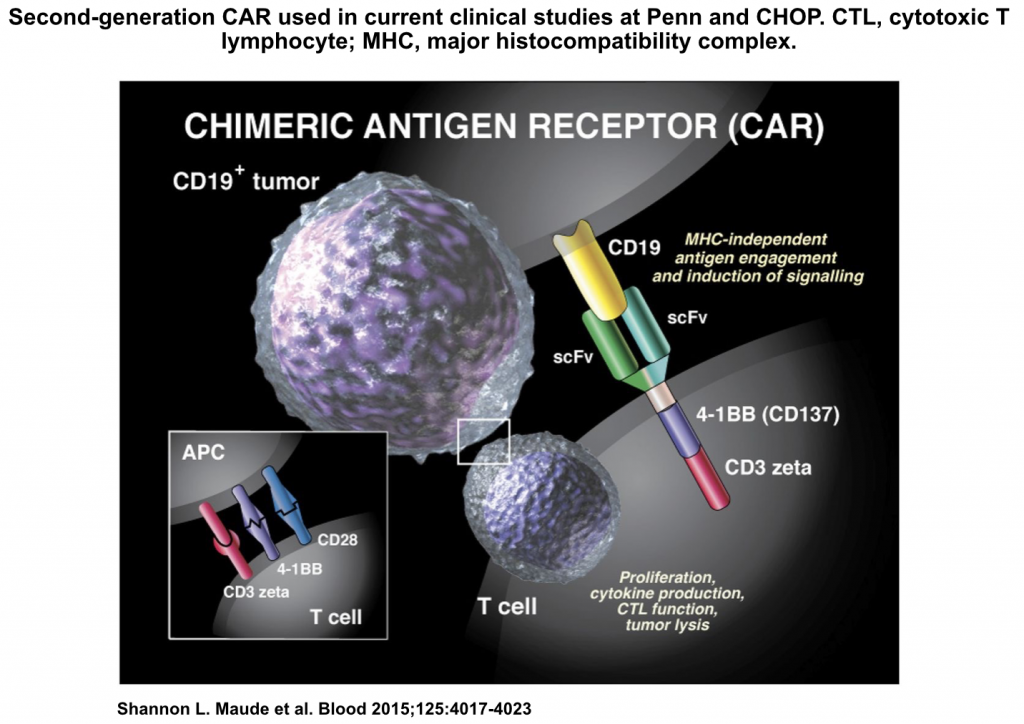
Wechselwirkung zwischen Tumorzelle und CAR T-Zelle. Quelle: Artikel in Blood 2015 –
http://www.bloodjournal.org/content/125/26/4017?sso-checked=true; Autoren: Shannon L. Maude und Kollegen
Erfolgreicher Kampfeinsatz
Vor dem Training werden dem Patienten mittels Apherese – was ähnlich einer Dialyse funktioniert – T-Zellen entnommen. In diese T-Zellen werden nicht-infektiöse Viren eingeschleust, in deren Genom man zuvor CAR-Gene eingebaut hat. Zurück im Körper, übersetzt die T-Zelle die CAR-Gene in Proteine. Dabei entsteht ein Oberflächenrezeptor, der ein bestimmtes Krebsartigen erkennt sowie verschiedene Signalproteine, die für die Aktivierung und Vermehrung der CAR T-Zellen verantwortlich sind.
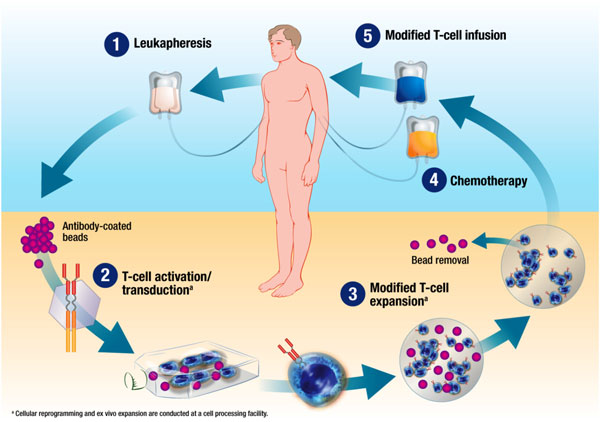
Patienteneigene T-Zellen werden mittels Apherese entnommen, gentechnisch modifiziert und dem Patienten wieder verabreicht: Fertig ist die Immuntherapie. Quelle: Artikel in http://global.onclive.com/publications/contemporary-oncology/2014/august-2014/chimeric-antigen-receptor-car-t-cell-immunotherapy-for-leukemia-and-beyond?p=3#sthash.UCewufhw.dpuf. Copyright: 2014 Novartis Corporation
Nachdem 2013 die Heilung des todkranken Milton Wright in den Medien hohe Wellen geschlagen hatte, sorgte 2014 eine Publikation der Universität Pennsylvania im „New England Journal of Medicine“ für Furore und heizte die Hype um die neue Therapie weiter an. Ergebnis der publizierten Studie: Zwei Drittel der Patienten, die an verschiedenen Formen von therapieresistentem Blutkrebs litten, waren selbst nach sechs Monaten noch frei von Krebs.
Die Patienten waren mit modifizierten T-Zellen behandelt worden, deren Erkennungsstelle auf das Antigen CD19 auf B-Zellen-assoziierten Tumoren zielt. Ähnlich ermutigende Daten veröffentlichte auch das National Cancer Institute (NCI) von Kindern mit ALL. In deren Hirnmetastasen fanden die Forscher nicht nur modifizierte T-Zellen, diese hatten auch zahlreichen Tochtergeschwülsten erfolgreich den Garaus gemacht.
Gedächtniszellen gegen Metastasen
Dass CAR T-Zellen auch bei soliden Tumoren wie Hirnmetastasen wirksam sein könnten, davon ist Behnam Badie, Chef der Abteilung Neurochirurgie der City of Hope in den USA, schon lange überzeugt. Schließlich will der Mediziner fortgeschrittene Hirntumoren bald mit modifizierten T-Zellen behandeln, die er direkt in den Hirntumor injiziert. Dabei setzt er auf Gedächtniszellen, also Zellen, die im Rahmen einer Immunattacke entstehen, und den Vorteil besitzen, dass sie sich an frühere Angreifer erinnern. Damit möchten wir sicherstellen, sagt Badie, dass auch vereinzelt zurückbleibende Krebszellen der Körperabwehr nicht mehr so einfach entwischen.
Die im April von der Penn State und der Harvard University publizierten Phase-I-Daten, lassen Badies Idee, Hirntumore schon bald mit CAR T zu behandeln, gar nicht mehr so verwegen erscheinen. Die Forscher hatten Patienten mit einem Glioblastom CAR T-Zellen mit einer Erkennungsstelle für einen tumorspezifischen Rezeptor – den epidermalen Wachstumsfaktors, kurz EGFRvIII – verabreicht. 30 % dieser bösartigen Hirntumore tragen diesen Rezeptor auf ihrer Oberfläche.
Als die Mediziner nach der Behandlung CAR-positive wie CAR-negative aktivierte T-Zellen im Tumorgewebe fanden, war klar: CAR T-Zellen gelangen aus dem Blut ins Tumorgewebe, ohne dort sofort von der immunfeindlichen Umgebung ausgeschaltet zu werden. Am Dartmouth-Hitchcock Norris Cotton Cancer Center haben sich Forscher in den Kopf gesetzt, verschiedene solide Tumoren mit einem universellen Rezeptor zu behandeln. Mit dem Transmembran-Rezeptor NKG2D natürlicher Killerzellen wurde nun ein solches universelles Multitalent aufgespürt, das bald in CAR T-Zellen genutzt werden soll.
Vorsicht Cytokinsturm
Trotz aller Euphorie, die Nebenwirkungen von CAR T können lebensbedrohlich sein. Die massenhafte Freisetzung von Cytokinen – auch Cytokinsturm genannt – ist gefürchtet und hat schon einigen Patienten das Leben gekostet. Untersuchungen haben ergeben, hohe Konzentrationen an Interleukin 6 (IL-6), ausgelöst durch eine zu heftige Aktivierung des Immunsystems, scheinen dafür verantwortlich. Die Ansätze zur Verringerung von IL-6 sind unterschiedlich: Naheliegend ist die Verabreichung von Kortikosteroiden oder Entzündungshemmern wie Enbrel® oder Actemra®.
Michel Sadelain vom Memorial Sloan Kettering Cancer Center bevorzugt einen direkteren Weg: IL-6 Antikörper sollen IL-6 abfangen, noch bevor es zum Cytokinsturm kommt. Innovativ erscheint das Konzept der Firma Bellicum aus Texas, der Universität von Leiden in den Niederlanden und des NCI: Das Trio baut Suizidschalter in CAR T-Zellen ein, die sich nach Bedarf an- und abschalten lassen, so dass die Zellen im Notfall Selbstmord begehen.
Wettlauf zum Produkt
Die zahlreichen Erfolge mit CART T haben am Markt einen Wettlauf um das erste Produkt ausgelöst. Die Vergabe von „Orphan Drug Status“ oder „Breakthrough Status“ durch die Zulassungsbehörden befeuern das Rennen zusätzlich. Biotechnologie-Unternehmen wie große Pharmakonzerne setzen gleichermaßen auf die vielversprechende Immunwaffe aus dem Labor: Juno, Kite, Cellectis, Bellicum, Novartis, Pfizer und Amgen sind nur einige Namen im Spiel um die erste erfolgreiche CAR T-Therapie.
Hier geht es zum Unternehmensprofil der Firma Juno Therapeutics.
| Institution/Firma | Datum | Partner | Deal |
| University of Pennsylvania | August 2012 | Novartis | keine näheren Angaben |
| Celgene | März 2013 | Bluebird Bio, Baylor College of Medicine | Unbekannte Vorauszahlung uns bis zu $225 Millionen pro Produkt |
| Cellectis | Juni 2014 | Pfizer | $80 Millionen Vorauszahlung und bis zu $185 Millionen pro Produkt, plus Lizenzzahlungen |
| Cellectis | Januar 2015 | Ohio State University | keine näheren Angaben |