Seit Jahrzehnten wird an der Entwicklung effizienter Nanotherapien gearbeitet – bisher mit eher mäßigem Erfolg. Neue Konzepte und Designs könnten bald den lang ersehnten Durchbruch bringen.
Mit Wirkstoffen beladene Nanoteilchen, die gezielt zum Krankheitsgeschehen navigieren und nur dort ihre Wirkung entfalten: Ein Traum, an dem sich Forscher aus aller Welt seit Jahren die Zähne ausbeißen. Intelligente Konzepte, deren Fokus nicht alleine auf Größe liegt, könnten die Realität dem Traum nun ein Stückchen näher bringen.
Vor fast 40 Jahren entdeckten Forscher zufällig die Fähigkeit der Lipide, sich in Wasser spontan zu winzigen sphärischen Strukturen – so genannten Mizellen – zu formieren. Diese Fähigkeit auf die gezielte Verabreichung von Wirkstoffen zu übertragen war nur ein logischer Schluss.Doch was einfach klingt, erwies sich als weitaus schwieriger – wie die nur marginalen Erfolge der letzten Dekaden beweisen. Mit Medikamenten beladene Nanoteilchen, die durch den Körper patroullieren, ihre Fracht in großer Menge gezielt im kranken Gewebe abladen und gesundes Gewebe verschonen – das war bisher eher Wunschtraum denn Realität. Techniken wie die Rasterkraftmikroskopie oder die optische Einzelmolekülspektroskopie, die detaillierte Einblicke in zelluläre Vorgänge und molekulare Wechselwirkungen ermöglichen, haben die Komplexität maßgeschneiderter Nanotherapien sichtbar gemacht und so zur Entwicklung neuer Konzepte beigetragen.
Die geringe Größe (1 nm = 10-9 m) ist ein wichtiges Charakteristikum von Nanopartikeln und sorgt für deren einzigartigen Eigenschaften. Produkte, die solche Eigenschaften nutzen, gibt es zahlreich. Von wasser- und schmutzabweisenden Beschichtungen für Autolacke, Fenster und Kleidung über Zahncremes mit nanostrukturiertem Zahnschmelz bis hin zu Kosmetika. Für einen erfolgreichen Einsatz in der Medizin ist die geringe Größe aber nur ein Kriterium.
Größe ist nur ein Aspekt
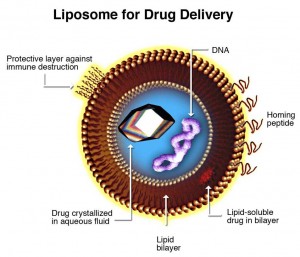
Unterschiede von Zellzwischenräumen in gesunden und kranken Geweben sind ein wichtiger Aspekt, wenn es um eine gezielte Verabreichung von Wirkstoffen geht. Doch um krankes Gewebe zielgenau anzusteuern und dort in ausreichender Menge anzukommen, reicht eine geringe Größe alleine nicht aus. Faktoren wie Gewebespezifität, Halbwertszeit – also Verweildauer im Körper – sowie Freisetzungskinetik spielen eine gleichberechtigte Rolle. Nach 20 Jahren intensiver Forschung wird immer klarer: Liposome sind nicht unbedingt die erste Wahl, wenn es um die gezielte Verabreichung von Medikamenten geht. Ihr größtes Manko: eine nur limitierte Anzahl verfügbarer Wirkstoffe und eine weitgehend vom Zufall gesteuerte Freisetzungsrate.
Feind Immunabwehr
Bei der Entwicklung einer effizienten Nanotherapie darf außerdem die körpereigene Immunabwehr nicht unterschätzt werden. Das auf eingedrungene Fremdstoffe geeichte Abwehrsystem erkennt die meisten Nanoteilchen als körperfremd und alarmiert daraufhin eine Armada verschiedener Abwehrstoffe. Noch bevor die Nanoteilchen ihr gewünschtes Ziel erreichen, werden zahlreiche von ihnen attackiert und aus dem Organismus entfernt. Nackte Liposome haben nur wenige Chancen dem Immunsystem zu entkommen, dies zeigt ein wissenschaftlicher Artikel aus dem Jahr 2013 in ACS Nano. Nur 5 % der gesamten Dosis eines liposomalen Wirkstoffes kommt demnach im kranken Gewebe an – oft zu wenig für eine effiziente Therapie.
Liposomale Nanotherapien
Freisetzungsprobleme und immunologischer Abbau haben die Entwicklung liposomaler Wirkstoffe aber nicht aufhalten können. Im Jahr 1995 wurde mit Doxil® der erste Nanowirkstoff zugelassen. Das in Liposomen verkapselte Chemotherapeutikum Doxorubicin wird zur Behandlung verschiedener Krebserkrankungen eingesetzt. Im Jahr 2004 erhielt mit MyoCet® das erste pegylierte Nanotherapeutikum zur Behandlung von Brustkrebs die Marktzulassung. Die als Pegylierung bezeichnete Beschichtung mit Polyethylenglykol sorgt im Organismus für eine Anlagerung von Wassermolekülen und soll so den vorzeitigen Abbau der Nanoteilchen durch körpereigene Enzyme oder Antikörper verhindern. Dies führt zu einer verlängerten Halbwertszeit – also einer längeren Verweildauer im Körper.
Neuere Konzepte setzen auf die Kopplung von Liposomen mit anderen Technologien. Die Firma Alnylam beispielsweise koppelt Liposome mit der RNA-Interferenz. Vizepräsident Jared Gollob, der das Konzept kürzlich in einem Interview vorstellte, will damit in Zukunft nicht nur Krebs erfolgreicher behandeln. In einen Lipidmantel verpacken die Forscher siRNA (small interfering RNA), die dann im Zellplasma freigesetzt an komplementäre mRNA (messenger RNA) binden soll. Dieses, auch als „Gene Silencing“ bezeichnete Konzept soll das Umschreiben von am Krankheitsgeschehen beteiligter mRNA in Proteine verhindern und so den Krankheitsverlauf positiv beeinflussen.
Polymerbasierte Nanotherapien
Ein völlig anderes Konzept verfolgt Robert Langer, bei seiner Suche nach der optimalen Nanotherapie liegt sein Fokus auf einem komplexen Design. Viele Jahre hat der Forscher am Massachusetts Institute of Technology (MIT) an Nanopartikeln auf Basis von Kohlenwasserstoff-Polymeren experimentiert. Geht es nach Langer, sollen die Ausgangsstoffe Poly-Laktid (PLA), ein biodegradierbarer Polyester, und Polyethylenglykol (PEG) der gezielten Wirkstofffreisetzung endlich zum verdienten Erfolg verhelfen.
Und die Chancen stehen gar nicht so schlecht: Die durch das PEG gebildete Hydrathülle verhindert die Bindung von Blutproteinen wie beispielsweise Antikörper und trickst so das Immunsystem aus. Über das Design von PLA kontrolliert Langer die Diffusionsgeschwindigkeit und somit die Freisetzung des Wirkstoffes. Kleine Peptide auf der Oberfläche der Nanoteilchen binden an spezifische Oberflächenstrukturen, die sich nur auf krankem Gewebe finden. Das Ergebnis dieser komplexen Stuktur: eine längere Verweildauer, eine zielgerichtete Bewegung und eine hohe Wirkstoffkonzentration am Ort des Krankheitsgeschehens. Im Menschen müssen solche Nanoteilchen ihre Funktion und Sicherheit freilich erst noch unter Beweis stellen. Gelingt ihnen das, haben die gezielt wirkenden Nanotherapien Aussicht auf Erfolg.