Im Jahr 1999 läutete der Tod des 18-jährigen Jesse Gelsinger das vorläufige Ende der Gentherapie ein. Nach Höhen und Tiefen, lassen neue Ansätze nun auf ein Comeback des vielversprechenden Therapieansatzes hoffen.
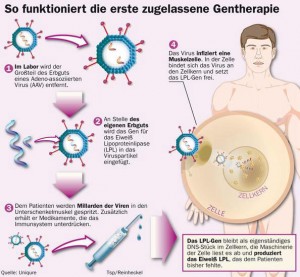
Jahrelang hat Jörn Aldag an Glybera getüftelt, vier Anläufe brauchte der Deutsche um die Europäische Zulassungsbehörde (EMA) von der Sicherheit und Wirksamkeit seiner Gentherapie zu überzeugen.2012 hatte er es endlich geschafft, die EMA gab grünes Licht und erteilte der ersten Gentherapie die Zulassung. Seit November 2014 ist Glybera gegen die seltene Lipoprotein-Lipase-Defizienz auf dem deutschen Markt erhältlich und soll – trotz des sagenhaften Preises von mehr als einer Million Euro – schon bald von den Krankenkassen erstattet werden. Ein Erfolg, der aufhorchen lässt und für weitere Dynamik in der Branche sorgen könnte.
Die Herausforderung
Seit den Anfängen der Genetik träumen Wissenschaftler davon, defekte Gene zu ersetzen und Erbkrankheiten den Garaus zu machen. Doch um ein funktionstüchtiges Gen in eine Zelle zu schleusen, bedarf es eines sicheren Transportvehicles. Viren – seit Jahrmillionen Spezialisten beim Kapern von Zellen – gelten als perfekte Genfähren. Doch die winzigen Gentaxis sind nicht ganz ungefährlich: sie sind körperfremd und nicht besonders wählerisch beim Einbau ihrer Erbinformation in das Wirtsgenom.
Wie gefährlich das werden kann, zeigt auch die Geschichte von Jesse Gelsinger. Ein allergischer Schock, ausgelöst durch Billionen modifizierter Adenoviren, führte zum Tod des Jugendlichen und damit zum vorläufigen „Aus“ der Gentherapie. Der willkürliche Einbau des Virusgenoms in die Wirts-DNA führte bei einer anderen Gentherapie zu einer verhängnisvollen Insertionsmutation. Fünf Kindern mit dem seltenen „Schweren kombinierten Immundefekt X1“ (SCID-X1) wurde diese zum Verhängnis. Sie erkrankten an Leukämie – ein Kind starb.
Neue Viren braucht die Gentherapie
Danach war klar, nur ein sicheres Transportvehicle konnte die Gentherapie noch retten. Mit den kaum pathogenen adeno-assoziierten Viren (AAV) schien ein solches Vehicle in greifbarer Nähe. Die meisten Menschen infizieren sich irgendwann im Leben mit einem AAV, was das Risiko einer überschießenden Immunantwort minimiert. Auf Grund verschiedener Serotypen besitzen AAV außerdem Präferenzen für bestimmte Zelltypen, dies ermöglicht geringere Virusmengen und damit wohl deutlich weniger Nebenwirkungen.Der Wendepunkt
2008 läutete das Children’s Hospital in Philadelphia den langersehnten Wendepunkt in der Gentherapie ein. Kinder mit der Erbkrankheit Lebersche Amaurose – ein Gendefekt der zur Erblindung führt – wurden erfolgreich gentherapeutisch behandelt. Die Mediziner nutzten AAV, um eine gesunde Variante des Gens RPE65 direkt in die Retina der betroffenen Kinder zu injizieren. Die Studienleiter Katherine High und Jean Bennett gründeten nach ihrem Erfolg in 2013 das Start-up Spark Therapeutics und sammelten 83 Millionen Dollar an Wagniskapital ein. Im Januar 2015 ging das Unternehmen an die Börse, was weitere 160 Millionen Dollar für die Forschung einbrachte.
Die Auswertung einer Phase III Studie ist Ende des Jahres geplant, die Zulassung der Gentherapie für 2016 anvisiert. Das nächste Ziel von Spark Therapeutics – eine Gentherapie gegen Hämophilie – hat bereits die Pharmaindustrie aufgescheucht. Auch Pfizer hat den Warnschuss vernommen und wohl ernst genommen – wie die jüngste Beteiligung mit fast 300 Millionen Dollar an der innovativen Therapie bestätigt. Noch in diesem Jahr soll die Gentherapie an Menschen getestet werden.
Eine Gentherapie gegen die Parkinson Krankheit ist der Traum des amerikanischen Start-ups Voyager Therapeutics, das bereits erste Patienten behandelt haben will. Eine direkt ins Gehirn gespritzte modifizierte Genfähre hat ein Protein im Schlepptau, das die Produktion des fehlenden Botenstoffes Dopamin ankurbeln soll. Ob dies auf Dauer funktioniert, muss sich allerdings noch zeigen. Der französische Pharmakonzern Sanofi ist zuversichtlich und schloss im Februar einen 845-Millionen-Dollar-Deal mit Voyager.
Ziel Massenindikation
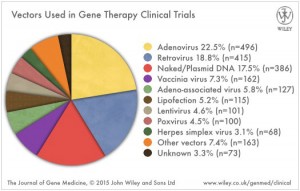
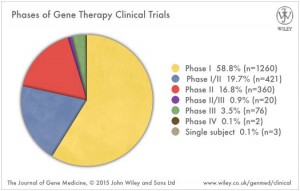
Eines ist anders bei den neuen gentherapeutischen Ansätzen, der Fokus liegt nicht ausschließlich auf verwaisten Krankheiten, auch Massenindikationen sollen demnächst gentherapeutisch behandelt werden. Ganz oben auf der Liste Krebserkrankungen und Erkrankungen des Herzens, die zu den häufigsten Zivilisationskrankheiten zählen. Ein Blick in das Fachmagazin „The Journal of Gene Medicine“ zeigt: 64,2 % aller Gentherapiestudien zielen auf die Behandlung von Krebs, 7,8 % testen kardiovaskuläre Erkrankungen. Die Nase vorn haben wie so oft die Amerikaner, die an 63 % der 2.100 Gentherapie-Studien beteiligt sind. Auf dem 2. Platz folgt mit 9,6 % Großbritannien und Platz 3 geht mit 3,9 % an Deutschland. (www.abedia.com/wiley/vectors.php).
Wie so ein gentherapeutischer Ansatz zur Behandlung von Krebs aussehen könnte, zeigt ein Projekt der University of Pennsylvania. Synthetisch hergestellte chimäre Antigenrezeptoren, so genannte CAR, werden in spezielle Immunzellen eingeschleust. Die Rezeptoren erkennen spezifische Oberflächenstrukturen auf Krebszellen und docken an diese an. Die anschließende Aktivierung des Immunsystems soll die Zerstörung der Krebszellen einleiten. Das neue Konzept scheint vielversprechend: von 120 Kindern mit Leukämie, die mit dem gentherapeutischen Ansatz behandelt wurden, waren 24 Ende 2013 noch immer symptomfrei.
Ein Herz für Herzpatienten hat die Firma Celladon aus Kalifornien. Ihre Gentherapie zielt auf SERCA-Enzyme, die in Zellen den Kalziumspiegel kontrollieren und deren Aktivität bei Herzschwäche und anderen typischen Herzerkrankungen verringert scheint. Eine Gentherapie mit AAV-Vektoren, die SERCA2-Gene in geschädigte Zellen des Herzmuskels einschleusen, soll bereits erfolgreich gewesen sein. Die US-Gesundheitsbehörde adelte die Gentherapie jüngst als „Durchbruch-Therapie.“ Wenn Rückschläge ausbleiben, stehen die Chancen der Gentherapie, sich endlich zu einer ernst zu nehmenden Therapieoption zu entwickeln, recht gut.