Vom schnöden Farbstoff zum Hoffnungsträger gegen Alzheimer – Methylenblau ist ein echtes Multitalent.
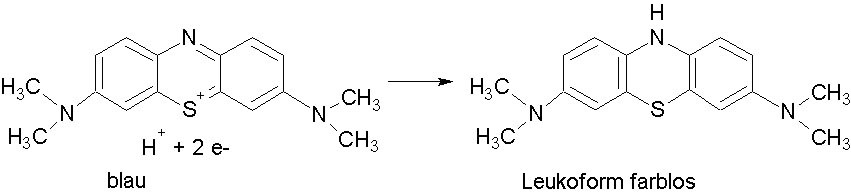
In der Chemie dient es als Redoxindikator, in der Medizin hat es sich als Vitalfarbstoff einen Namen gemacht und bei Methämoglobinämie wird es sogar als Antidot genutzt. Nun hat ein findiger Wissenschaftler ein ganz neues Einsatzgebiet gefunden: In derivatisierter Form soll Methylenblau die für Alzheimer typischen Tau-Fibrillen auflösen und so die Krankheit zum Stillstand bringen.
Glaubenskrieg: ß-Amyloid oder Tau?
Die Informationsweiterleitung im Gehirn erfolgt u. a. über Synapsen. Chemische Botenstoffe, die so genannten Neurotransmitter, werden in den synaptischen Spalt ausgeschüttet, überqueren diesen und gelangen mittels spezieller Rezeptoren in die nachfolgende Nervenzelle. Bei Alzheimer Demenz (AD) werden nach aktuellen Erkenntnissen sowohl Synapsen als auch Nervenzellen zerstört, die Informationsweiterleitung wird unterbrochen, die Leistungsfähigkeit des Gehirns nach und nach zerstört.
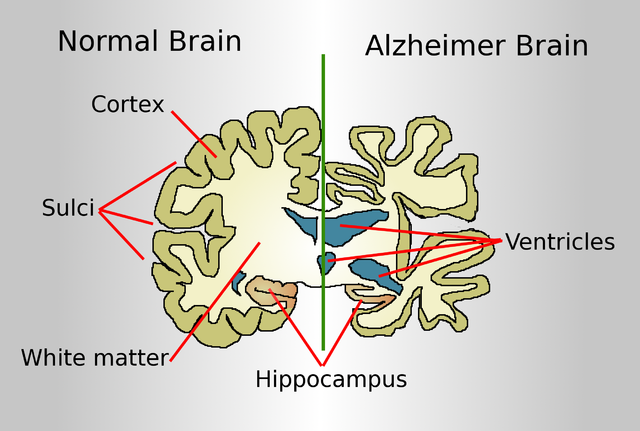
Vergleich eines gesunden und eines an Alzheimer erkrankten Gehirns. Copyright: By Garrondo – Own work, Public Domain, https-//commons.wikimedia.org/w/index.php?curid=4387759
ß-Amyloid-Plaques, die sich zwischen den Neuronen ablagern, waren lange als Ursache der AD favorisiert worden. Später etablierte sich die Tau-Hypothese, die Proteinaggregate aus Tau-Proteinen innerhalb der Neuronen verantwortlich machte. Neuere Studien gehen nun davon aus, beide Ablagerungen haben wohl die gleiche Ursache: veränderte löslich ß-Amyloid-Oligomere wie die Pyroglutamat-Abeta-Peptide, die durch enzymatische Spaltung aus dem Vorläuferprotein APP hervorgehen.
Pyroglutamat-Abeta-Peptide sollen sowohl für die Hyperphosphorylierung von Tau-Proteinen innerhalb der Nervenzelle, als auch für die Entstehung der unlöslichen extrazellulären ß-Amyloid-Plaques verantwortlich zeichnen. Außerdem sollen sie toxisch auf Synapsen wirken.
Mechanismus der Zerstörung
Aktuelle Forschungen zeigen, bei einer AD kommt es tatsächlich zu einer starken Ansammlung von löslichen ß-Amyloid-Oligomeren in den Neuronen, die sich in der Folge in die Umgebung ausdehnt. Es werden Nikotin-Acetylcholin-Rezeptoren (NMDA) auf bestimmten Hirnzellen, den Astrozyten, aktiviert und der Neurotransmitter Glutamat freigesetzt. Ein Überschuss an Glutamat soll eine starke Aktivierung von NMDA Rezeptoren auf Neuronen und einen Einstrom von Calcium-Ionen bewirken. Eine Änderung der mitochondrialen Funktion verstärkt wohl oxidativen Stress und endet mit einer Hyperphosphorylierung von Tau-Proteinen. Deren Aggregation führt letztlich zur Zerstörung der Mikrotubuli in der Nervenzelle.
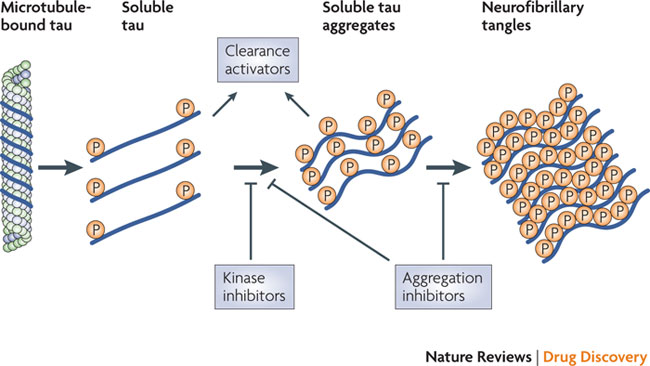
Hyperphosphorylierung von Tau Proteinen führt zu deren Aggregation und zur Zerstörung von Mikrotubuli in Neuronen. TauRX’s Methylenblau-Derivat verhindert die Aggregation. Andere Wirkstoffkandidation zielen auf einen verstärkten Tau-Abbau oder eine Hemmung der Kinasen, die die Phosphorylierung katalysieren. (Quelle & Copyright: Nature Reviews Drug Discovery 9, 387-398, 2010. doi:10.1038/nrd2896)
Gleichzeitig gelangen lösliche ß-Amyloid-Peptide auf Grund ihrer geringen Größe in den synaptischen Spalt, wo sie eine toxische Wirkung auf Synapsen ausüben sollen. Zwar fördern Pyroglutamat-Abeta-Peptide auch die Entstehung seniler Plaques in Form von polymerem ß-Amyloid. Diese Ablagerungen sollen aber wohl nicht mit Schäden an Nervenzellen und Synapsen einhergehen.
Methylenblau löst Tau-Fibrillen auf
Auch Claude Wischik gehört seit langem zu den Unterstützern der Tau-Hypothese. Schon 1985 arbeitete Wischik an der Universität von Cambridge an der Strukturaufklärung der helikalen Tau-Neurofibrillen. Eigentlich wollte Wischik lediglich seine Zellen anfärben, was er dabei zufällig entdeckte, veränderte seine berufliche Laufbahn. Der schöde Farbstoff Methylenblau löste die aus Tau-Proteinen bestehenden Neurofibrillen einfach auf. Seit dieser Zeit ist Wischik, der mittlerweile mit einem Kollegen das in Singapore sitzende Unternehmen TauRx gegründet hat, überzeugt, Methylenblau-Derviate sind Hoffnungsträger für eine wachsende Zahl an Demenzkranken.
Nach erfolgreichen in vitro Studien und Tierstudien mit Methylenblau gelang auch eine aussichtsreiche Phase II Studie mit dem Methylenblau-Derivat „Rembr.“ Dabei konnte das Fortschreiten der Erkrankung um etwa 81 % verringert werden. Für eine internationale Phase III Studie gelang Wischik anschließend die Akquise von 120 Millionen Euro.
NMR-Spektroskopie unterstützt Methylenblau-Wirkung
Eine in der Zeitschrift „Angewandte Chemie“ publizierte Studie untermauert die Wirkung von Wischiks Tau-Aggregationshemmern (TAI). Mittels NMR-Spektroskopie wurden zwei potenzielle Wirkmechanismen von Methylenblau sichtbar gemacht. Ergebnis: der Farbstoff reagiert mit Cysteinresten im Tau-Protein. Dabei klinkt sich zwischen den SH-Gruppen ein Sauerstoffatom ein, so dass die Disulfidbrückenbindung unterbleibt, die für die Aggregation der Tau-Proteine verantwortlich zu sein scheint. Außerdem kann sich Methylenblau an eine Faltblatt-Region des Tau-Proteins anlagern, was wohl die Anlagerung weiterer Faltblattstrukturen und damit die weitere Aggregation verhindert.
Mechanismus der Methylenblau-Wirkung
Das Wissen um die Wirkung von aggregiertem Tau-Protein hat in der Biotechnologie eine Jagd nach einem wirksamen Alzheimer-Wirkstoff ausgelöst. Auch weil sich die Zahl der Betroffenen von aktuell rund 20 bis 30 Millionen weltweit bis 2050 vervierfachen könnte – so aktuelle Prognosen – und bisherige Medikamente eher enttäuschend sind. Die Schweizer Nestlè setzt gemeinsam mit AC Immune auf Tau-Antikörper. Das Gleiche gilt für das Merck-Serono Spin-off AsceNeuron. AXON Neuroscience favorisiert einen Impfstoff gegen Tau-Fibrillen und Wischik ist fest vom Erfolg seines Tau-Aggregationshemmer – dem Methylenblau-Derivat LMTX™ überzeugt. Wer das Rennen macht, ist offen. Wischik will aber bereits 2016 erste Ergebnisse der laufenden Phase III Studie vorlegen und hat damit – zumindest zeitlich – die Nase vorn.