Angriff auf die Super-Proteinase
ß-Lactone, die relevante Zielstrukturen in Staphylococcus aureus angreifen und entschärfen, hat Sieber als Post-doc mit Hilfe der ABPP (activity based protein profiling) – die zur funktionellen Proteomik zählt – am Scripps Institute im Kalifornischen La Jolla ausfindig gemacht.
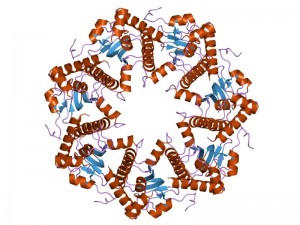
Eine Zielstruktur ist die Caseinolytische Protease P – kurz ClpP. Das zu den Serin-Proteinasen zählende bakterielle Enzym besteht aus insgesamt 14 Untereinheiten mit je einem aktiven Zentrum und scheint ein Schlüsselprotein bei der Entstehung von Virulenzfaktoren zu sein. Nach Siebers Beschreibung besteht das Super-Protein aus zwei aufeinanderliegenden Heptameren und sieht aus wie ein doppelter Donut. Wird das Bakterium von einem Antibiotikum attackiert, schützt ClpP es vor oxidativem Stress, indem es, analog einer molekularen Schere mit 14 Klingen, fehlerhafte Proteine einfach zerschneidet. Neben seiner unterstützenden Wirkung bei der Entstehung von Virulenzfaktoren spielt es auch eine tragende Rolle bei der Schwächung des Immunsystems.
Ein spezielles ß-Lacton, dessen Seitenkette nicht länger als acht Kohlenstoffatome sein darf, bindet laut Sieber an die Aminosäure Serin in den 14 aktiven Zentren von ClpP. So werden die Klingen der molekularen Schere stumpf, auch wenn die Protein-Struktur intakt bleibt. Anders verhält es sich bei ß-Lactonen mit einer aromatischen Seitenkette, sie spalten ClpP in die beiden Heptamere und inaktivieren es.
Herausforderung Stabilität
Einen Stolperstein muss das interdisziplinäre Team noch aus dem Weg räumen: Die geringe Stabilität der Lacton-Vierringstruktur, die eine orale Gabe verhindert. Gemeinsam mit dem Max Planck Institut für Molekulare Physiologie in Dortmund wurden deshalb mittels High-Throughput-Screening 138.000 Verbindungen auf ihre Stabilität untersucht. Sieben Verbindungen – die einen Phenylester enthalten – können ClpP ebenfalls in zwei Heptamere spalten und es inaktivieren. Im Gegensatz zu den in Mäusen bereits positiv getesteten ß-Lactonen, die in drei bis vier Jahren in klinischen Studien getestet werden könnten, ist die Wirkung der Phenylester in Tieren aber noch unbekannt.
Angriff auf die Genaktivität
Mit Inhibitoren für Transkriptionsaktivatoren, die Gene von Virulenzfaktoren erst anschalten und damit die bakterielle Waffenproduktion einleiten, besitzt Sieber noch einen weiteren Joker. Die Derivate von Alpha-Methylen-Gamma-Butyrolactonen waren in Staphylococcus aureus bereits vielversprechend: Nach Zusatz der potenziellen Hemmstoffe ließ sich der Virulenzfaktor Hämolysin nicht mehr nachweisen. Dass diese Hemmstoffe auch für menschliche Zellen toxisch sind, entmutigt den Zweimetermann Sieber nicht, mit seinem Team arbeitet er bereits an chemischen Veränderungen, die den Verbindungen ihre Humantoxizität nehmen sollen. Was Sieber und seinem Team noch fehlt ist ein finanzstarker Investor, der vor dem Risiko des frühen Entwicklungsstadiums nicht zurückschreckt und das Projekt möglichst bald in die klinische Entwicklung bringt.