Göttinger Wissenschaftler knacken mit MINFLUX den Heiligen Gral der Fluoreszenzmikroskopie
Der Abbe’sche Sinussatz ist ein unumstößliches physikalisches Gesetz. Doch mit Hirnschmalz und neuartigen optischen Verfahren lässt es sich austricksen, wie Nobelpreisträger Stefan Hell jüngst unter Beweis stellen konnte.

Stefan Hell (li.) und sein Team optimieren ihr MINFLUX Fluoreszenzmikroskop. Quelle/Rechte: MPI für biophysikalische Chemie, Göttingen
Der deutsche Physiker Ernst Abbe erkannte im 19. Jahrhundert, dass für den Durchgang von Lichtstrahlen durch eine Linse neben den Brechungsgesetzen auch die Lichtbeugung eine Rolle spielt. Damit setzte Abbe, der als Vater des wissenschaftlichen Mikroskopbaus gilt, ein Limit für das lichtmikroskopische Auflösungsvermögen und damit Grenzen zur Beobachtung lebender Zellen. Gemäß dem Abbe’schen Sinussatz müssen zwei Objekte nämlich einen Mindestabstand von der halben Lichtwellenlänge (> 200 Nanometer) aufweisen, um noch als optisch und räumlich getrennt voneinander wahrgenommen zu werden.
Abbe-Limit austricksen
Am Max-Planck-Institut (MPI) für biophysikalische Chemie in Göttingen hat sich Stefan Hell mit Haut und Haaren der Mikroskopie verschrieben. Dass sich das Abbe-Limit mit kreativen Ideen austricksen lässt, davon war der Physiker schon lange überzeugt. Seinem Ziel, molekulare Prozesse in lebenden Zellen in Echtzeit zu studieren, kam er bereits 1994 einen Schritt näher. Hell erdachte das STED-Mikroskop (Stimulated Emission Depletion) und setzte seine Idee fünf Jahre später auch experimentell um. Mit STED erreichte er als Erster eine Trennschärfe von etwa 20 bis 30 nm und damit bereits rund zehnmal mehr Auflösung als im Abbe-Limit formuliert. 2014 wurde Hell für seinen Geistesblitz, zusammen mit zwei anderen Forscherteams, die ein paar Jahre später mit PALM/STORM (Photoactivated Localization Microscopy/ Stochastic Optical Reconstruction Microscopy) ähnliche Verfahren erdachten, mit dem Nobelpreis für Chemie ausgezeichnet.
Der Beugung ein Schnippchen schlagen
Ernst Abbe würde nicht schlecht staunen, denn mit STED gelang Hell die erste Fluoreszenz-Lichtmikroskopie-Methode, deren Auflösung nicht mehr durch die Lichtbeugung begrenzt war. Damit benachbarte Moleküle als getrennt erscheinen und nicht durch Beugung verschwimmen, musste Hell auf einen Kunstgriff zurückgreifen: Benachbarte Moleküle, die ihre Fluoreszenz nicht gleichzeitig, sondern nacheinander abgeben, lassen sich getrennt wahrnehmen. Um die Fluoreszenz von Molekülen also gezielt ein- oder auszuschalten, bediente sich Hell molekularer Prozesse wie Elektronenübergängen oder der Umsortierung von Atomgruppen.
Die physikalisch-chemischen Details sind kompliziert, doch grob funktioniert STED in etwa so: Ein Lichtstrahl regt die Fluoreszenzmoleküle an, während ein nachfolgender zweiter Strahl, der STED-Strahl, sie sofort wieder abregt, so dass sie kein Licht emittieren. Damit aber nicht alle Moleküle dunkel bleiben, besitzt der STED-Strahl eine ganz besondere Form, er ähnelt einem Donut, besitzt also in der Mitte ein Loch. Auf diese Weise schaltet der STED-Strahl nur die Fluoreszenz der Moleküle am Rand aus, während die innerhalb des Loches weiterhin fluoreszieren. Wird die gesamte Probe mit dem STED-Strahl abgerastert, entsteht ein Abbild der Probe.
Schärfer geht’s nicht mehr
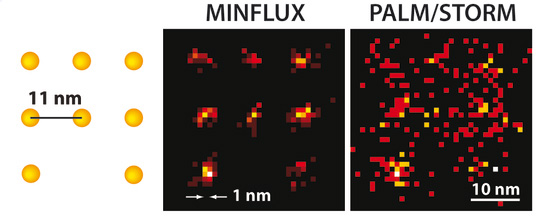
Das MINFLUX-Mikroskop kann erstmals wenige Nanometer voneinander entfernte Moleküle optisch unterscheiden (links). Der Vorgänger PALM/STORM zeigt dagegen nur diffuse Punkte. Quelle/Rechte: MPI f. biophysikalische Chemie/ K. Gwosch
Im Dezember letzten Jahres sorgten Hell und sein Team erneut für Aufsehen, indem sie es bis an die Grenze der fluoreszenzmikroskopischen Auflösung schafften und so den „Heiligen Gral“ knackten. MINFLUX (minimal emission fluxes, minimale Emissionsflüsse) heißt die neue Technik und ist das erste Fluoreszenzmikroskop das nur einige Nanometer voneinander entfernte Moleküle noch einzeln auflösen kann. Damit sei die Methode 100 Mal schärfer als die konventionelle Lichtmikroskopie und überträfe auch die STED-Mikroskop um das bis zu 20-Fache, sagt Hell. „Die Aufgabe war alles andere als trivial, aber meine Mitarbeiter Francisco Balzarotti, Yvan Eilers und Klaus Gwosch haben hervorragende Arbeit geleistet und die Idee experimentell mit mir umgesetzt“, erläutert Hell die Herausforderung in der jüngsten Presserklärung.
In der Dezemberausgabe des Fachjournals Science wird MINFLUX im Detail erläutert: Wie die PALM/STORM-Technik schaltet MINFLUX einzelne Moleküle ganz zufällig an und aus. Von STED nutzt sie den Donut-förmigen Laserstrahl, der die Position der Moleküle erfassen kann. Im Gegensatz zu STED wird der ringförmige Laser aber nicht zum Abregen, sondern zum Anregen der Fluoreszenz genutzt. Es leuchtet also das Molekül auf dem Donut-Ring und nicht das im Zentrum. Die exakte Position des Moleküls berechnen die Göttinger anschließend mit Hilfe eines intelligenten Algorithmus.
„Mit MINFLUX erreichen wir Auflösungen von einem Nanometer, das ist der Durchmesser einzelner Moleküle und die ultimative Grenze dessen, was in der Fluoreszenzmikroskopie möglich ist“, beschreibt Hell die Möglichkeiten des neuen Verfahrens. Da die Kombination aus STED und PALM/STORM nicht-invasiv sei, werde es die Erforschung molekularer Prozesse in lebenden Zellen in Echtzeit enorm voranbringen, glaubt Hell.
Mit MINFLUX eine 100 Mal bessere Zeitauflösung
Neben der verbesserten molekularen Auflösung soll MINFLUX auch deutlich schneller sein als bisherige Verfahren. So lasse sich die Bewegung von Molekülen in einer Zelle mit einer 100 Mal besseren zeitlichen Auflösung verfolgen, sagt Teammitglied Eilers, der in einem Video die Bewegung von Molekülen in einem lebenden E. coli-Bakterium in bisher unerreichter Zeitauflösung „filmen“ konnte. Eilers glaubt, dass die Möglichkeiten von MINFLUX hinsichtlich Geschwindigkeit sogar noch Luft nach oben haben. Künftig sollen selbst extrem schnelle Abläufe in lebenden Zellen, wie beispielsweise die Faltung von Proteinen oder die Bewegung zellulärer Nanomaschinen, mit MINFLUX untersucht werden. Behalten die Forscher Recht, dürfte dies das Wissen über die molekularen Abläufe in lebenden Zellen revolutionieren.
Zusätzliche Informationen:
PALM/STORM-Mikroskopie
PALM/STORM steht für Photoactivated Localization Microscopy bzw. Stochastic Optical Reconstruction Microscopy. Beide sind spezielle Methoden der Fluoreszenzmikroskopie, die Licht nutzen, um Fluoreszenzen in einzelnen Molekülen ein- und auszuschalten, um so die Beugungsgrenze zu überwinden. Das Ein- und Ausschalten erfolgt dabei über einen gewissen Zeitraum, so dass mehrere Einzelbilder aufgenommen werden. Benachbarte Moleküle werden so auf die einzelnen Bilder verteilt und ihre Positionen werden mittels eines Algorithmus ermittelt.STED-Mikroskopie
STED-Mikroskopie steht für Stimulated Emission Depletion und kann die Beugungsgrenze deutlich überwinden. Dem Anregungsstrahl folgt ein rotverschobener, ringförmiger Lichtstrahl. Durch diesen ringförmigen Lichtstrahl fallen die angeregten Moleküle über stimulierte Emission an den Rändern wieder in den Normalzustand. Dadurch verkleinert sich das emittierende Volumen und die Auflösung erhöht sich.